Gタンパク質共役型受容体とは?
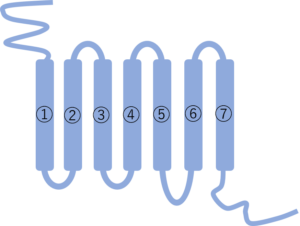
Gタンパク質共役型受容体とは上の図のような構造を持つもち脂質二重膜を7回貫通している。(7回膜貫通型受容体ともいわれる)構造的特徴としてはお互いに接近するαヘリックス鎖が7回膜を貫通し、N末端を細胞外にC末端を細胞内に向けている。
この受容体は水溶性リガンドのシグナルを受け取り伝達する。水溶性リガンドは脂質二重膜を通過できないため、GCPRなどの受容体を介して細胞内に情報伝達を行う。リガンドの代表例として、アドレナリンやグルカゴンなどが挙げられる。
薬学的意義
医薬品のうち45%が受容体に作用する薬剤であり、その大部分を占めるのがGCPRに関連する薬剤である。
GCPRは多くのホルモンや神経伝達物質の主要な受容体として知られており、ヒトゲノム情報によると約1000種類存在し最大の遺伝子ファミリーを形成する。((GCPRの半数がにおいの受容体で残りの受容体が生理活性物質のGCPRである))
いまだに120程度のGCPRが内在性アゴニスト不明のオーファン(孤児)受容体であると考えられており、これらの究明・機能解析は医薬品開発への手がかりとして非常に有用である。
またGタンパク質受容体の活性化の流れや各組織での生理作用をマスターすることで暗記量を減らせるため、しっかりと理解しておくべきである。
そもそもGタンパク質とは?
Gタンパク質とはグアニンヌクレオチド結合タンパク質のことを指す。グアニンヌクレオチドとはGDPやGTPのことであるので、「GDPやGTPが結合するタンパク質」といえる。
Gタンパク質共役型受容体の活性化
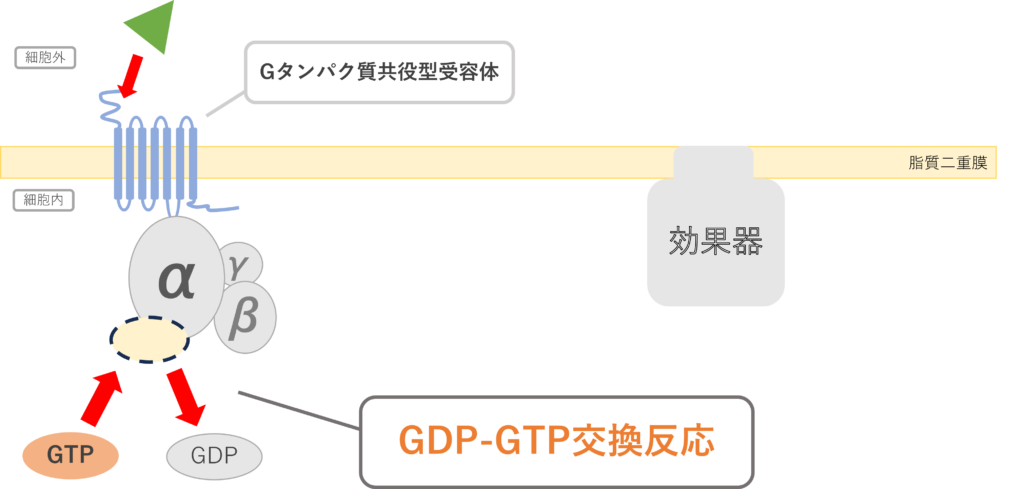
①平常時:シグナルが入っていないときは不活性化型で存在する。3量体Gタンパク質複合体のαサブユニット上にGDPが結合している。

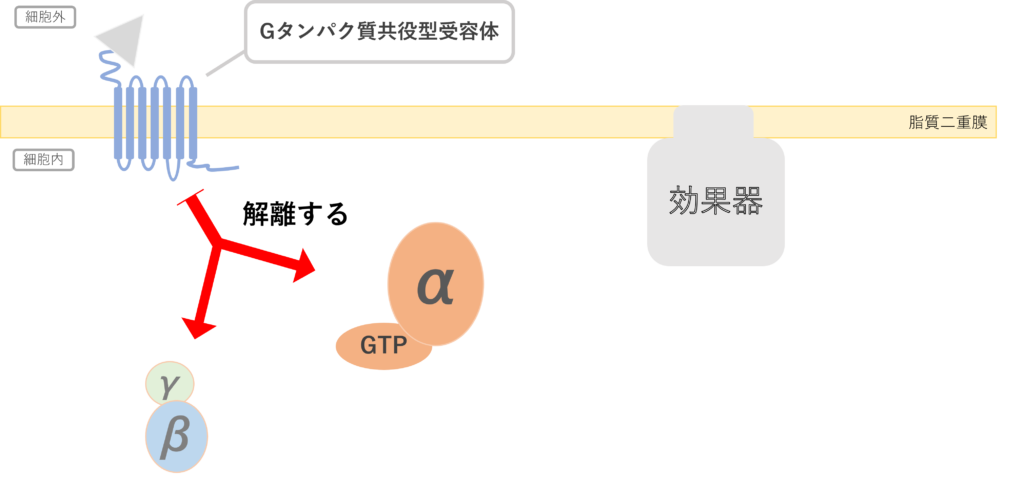
②受容体の細胞外ドメインにリガンドが結合し、αサブユニット上のGDPがGTPへと交換される。上記の反応をGDP-GTP交換反応といい、グアニンヌクレオチド交換因子(GEF:Guanine nucleotide Exchange Factor)によって活性化される。
活性化されたGタンパク質はどのようにして不活性化状態に戻るのか?
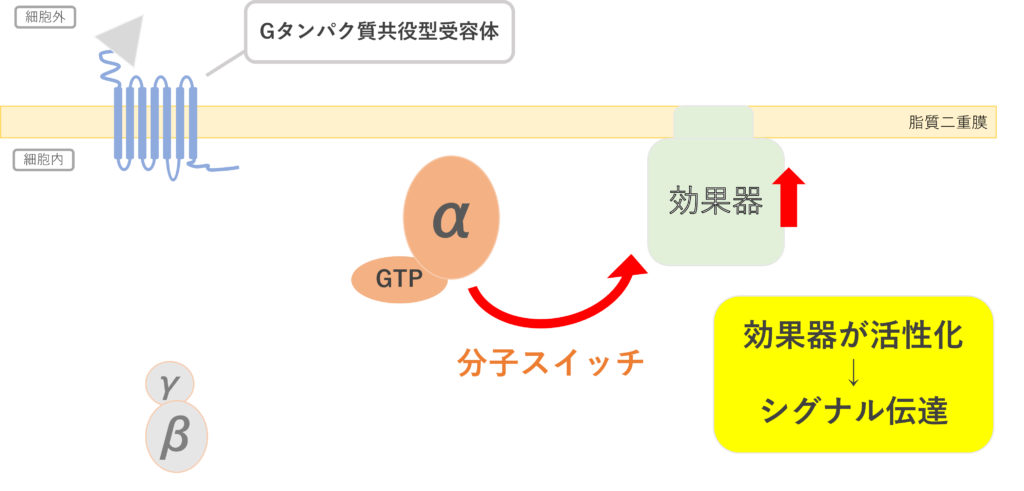
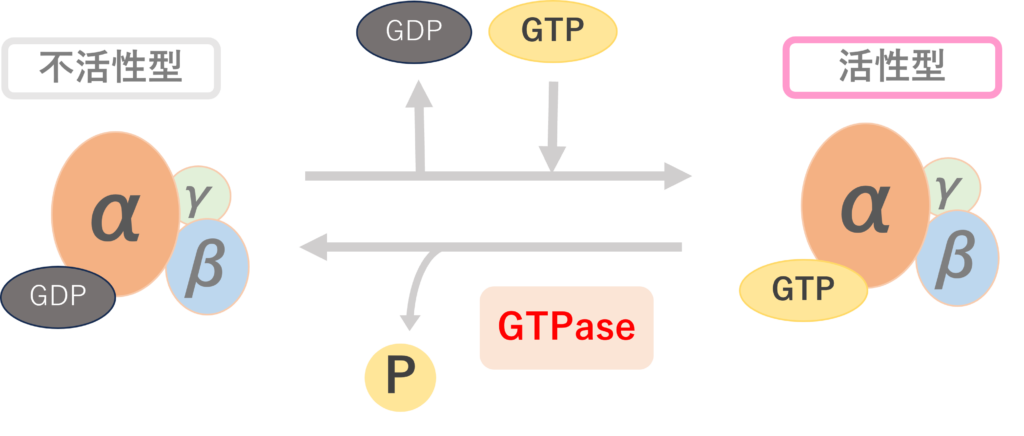 活性化されたGタンパク質はGTPaseによってGDPに加水分解され不活性型になる。Gタンパク質単体でもGTPase活性を有しているが、その活性は弱いためすぐに戻すことはできない。
活性化されたGタンパク質はGTPaseによってGDPに加水分解され不活性型になる。Gタンパク質単体でもGTPase活性を有しているが、その活性は弱いためすぐに戻すことはできない。
そこで、細胞内にはGTPaseを活性化するGTPase活性化因子(GTPase- activating protein:GAP)と呼ばれる因子がある。
その後の反応やGタンパク質共役型受容体の分類については以下の記事を参考に!



